根据国家卫健委《关于印发涉及人的生命科学和医学研究伦理审查办法的通知》(国卫科教发〔2023〕4号)精神,所有涉及人的生物医学研究项目在实施前,需要在国家医学研究登记备案信息系统(以下简称备案系统,网址:https://www.medicalresearch.org.cn)登记备案。为此,广医二院药物临床试验机构从2023年7月1日起,将组织在本院开展的符合要求的药物/医疗器械临床试验项目进行备案。
一、备案范围:
2023年7月1日后新立项的,或者在2020年-2023年7月1日期间结题或仍在进行的,且以本院为组长单位及在本院单中心开展的注册类药物/医疗器械临床试验。
二、注意事项:
熟练掌握“医学研究登记备案信息系统”https://www.medicalresearch.org.cn/login
设立单位科学审查委员会,并在系统备案
设立单位伦理委员会,并在系统备案
根据需要是否需要设立学术委员会(研究者发起的临床研究非必需,但是临床药物实验、干细胞/体细胞备案均需要)
三、备案流程:
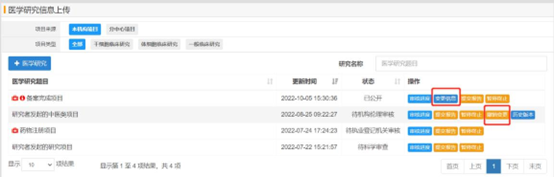
医学研究信息填写
项目负责人新增研究项目或编辑研究项目时,需要依次填写项目的各项信息;
![]()
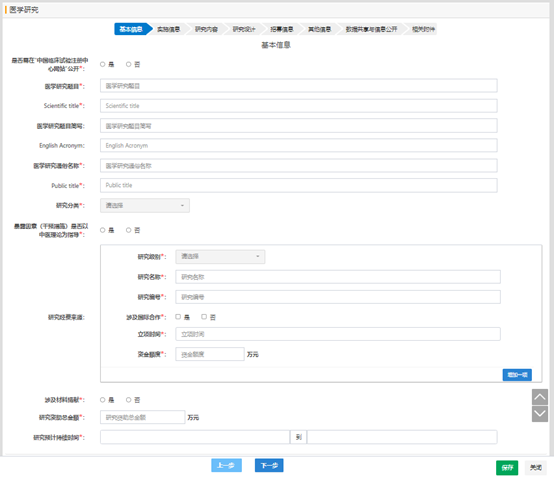
如果有发文的需求,需要将项目信息同步到中国临床试验注册中心时, 是否需在“中国临床试验注册中心网站”公开的选项选“是”,填写各项需要的英文信息,后续备案完成后,会将项目信息同步至中国临床试验注册中心;如果英文信息填写不对,或英文信息中填写中文信息,都将不会同步。
“暴露因素(干预措施)是否以中医理论为指导”选“是”时,默认为中医类项目,提交审核时,试点省份(目前十二个试点省份(第一批试点省份:北京、上海、广州、海南;第二批试点省份: 河北、 辽宁、 江苏、浙江、 山东、 湖南、 重庆、 四川))需要进行学术审核。
实施单位默认为项目负责人所在的单位,如果项目负责人在其他机构开展的临床研究,可以根据情况变更项目的实施单位。
对于多中心项目备案时,临床研究分中心选择“有” ,参与单位可以添加多个,输入机构名称或项目负责人时,会有自动提示,有名称匹配的尽量通过下拉选择,这样分中心及分中心负责人,登录后会直接查看到项目;如果手动输入,则匹配不到信息,分中心及分中心负责人看不到该项目的信息。
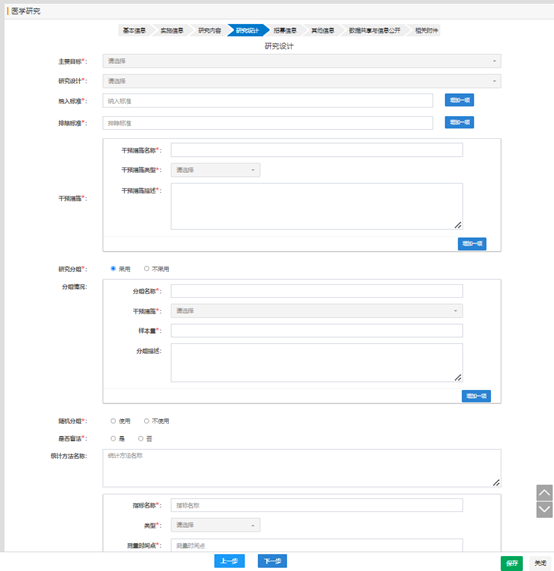
对于干预性研究,需要填写研究自评价的信息。
项目的学科分类和 ICD11 分类,请根据研究项目的所主要治疗或观察的相关疾病信息,进行选择。
研究的具体疾病或症状,不用填写太多无关的信息,只要填写相关的疾病名称或症状信息即可。
当“研究分组”选择有时, 分组中的干预措施需要选择,否则提交时会有错误提示信息。
研究项目的招募信息填写:
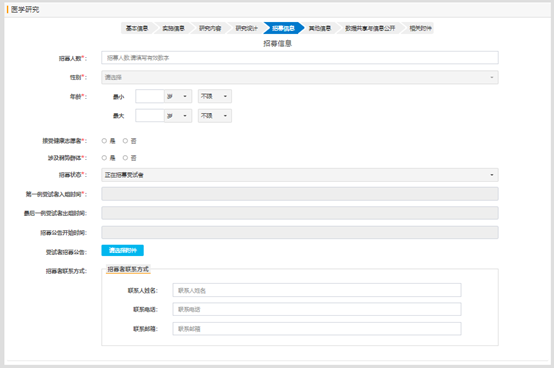
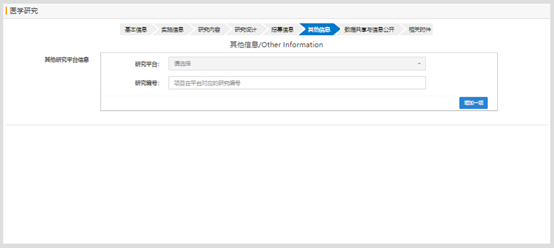
研究项目如果在其他平台进行注册过,需要选择平台并填写对应平台的研究编号;如果没有,则不需要填写;如果选择了平台,不填写编号的话,提交时,会提示信息不齐,提交失败。
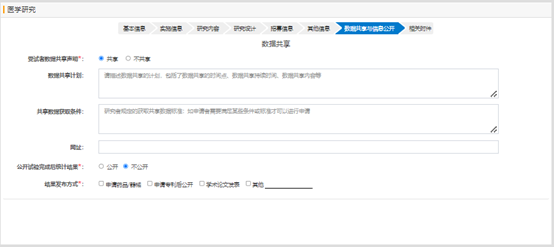
相关附件部分,需要上传研究方案、知情同意书模板或知情同意豁免申请书,
医学研究信息提交
确认项目信息填写无误后,需要项目负责人,点击“提交” 按钮,提交研究项目审核,授权人是不能提交审核的,会出现提交失败的提示。如果提交时出现信息失败提示,请按照提示信息进行补充,补充完毕后,方可提交。
研究者提交时,不需要选择学术委员会审核,只需要选择伦理委员会(伦理办联系电话:34153599)进行审核。
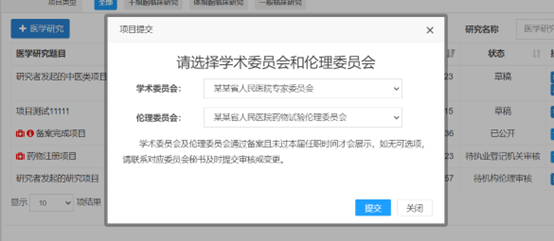
常见的提示说明
1、 干预性研究需要有医师
干预性研究需要项目负责人为医师,或者团队成员中有医师;如果确认团队中有医师的话,需要在医师的个人信息里,职称选择卫生技术人员,主任医师、副主任医师、主治医师、医师、医士中的任一个,方可提交。
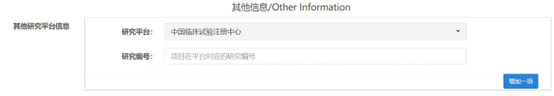
2、 项目在平台对应的研究编号为空
如果项目在其他信息里选择了研究平台的话,就需要填写对应的编号,如果不填写编号进行提交的话,就会出现上面的提示信息,如下图所示:
项目变更
项目信息备案完成后,可以进行变更,审核完成的项目进行变更时,将记录历史版本信息,方便后续对比查看;当信息表更后,未经机构审核前,可以选择“撤销变更”,还原信息到上一个版本,如下图所示